高中化学常识知识大全涵盖了化学的基本概念、物质的性质、化学反应类型、实验操作以及化学与生活的联系等多个方面,掌握这些知识不仅有助于理解化学学科的核心内容,还能解决日常生活中的实际问题,以下将从物质的分类、基本概念、化学反应、实验操作、化学与生活五个方面进行详细阐述。
物质的分类是化学学习的基础,根据物质的组成,物质可分为纯净物和混合物,纯净物由一种物质组成,分为单质(如氧气O₂、铁Fe)和化合物(如水H₂O、氯化钠NaCl),混合物由两种或多种物质混合而成,如空气、溶液,根据物质的导电性,物质可分为导体(如金属)、半导体(如硅)和绝缘体(如橡胶),根据物质的状态,可分为固态、液态和气态,三者在一定条件下可相互转化,如水的三态变化(冰→水→水蒸气)。

化学基本概念包括物质的量、摩尔质量、气体摩尔体积等,物质的量(n)是表示含有一定数目粒子的集合体,单位为摩尔(mol),1mol任何粒子所含的粒子数约为6.02×10²³(阿伏伽德罗常数),摩尔质量(M)是单位物质的量的物质所具有的质量,单位为g/mol,数值上等于该物质的相对原子质量或相对分子质量(如H₂的摩尔质量为2g/mol),气体摩尔体积(Vₘ)是指在标准状况下(0℃、101kPa),1mol任何气体所占的体积约为22.4L,物质的量浓度(c)是指单位体积溶液中所含溶质的物质的量,单位为mol/L,计算公式为c=n/V。
化学反应是化学研究的核心内容,主要包括化合反应、分解反应、置换反应和复分解反应四大基本类型,化合反应是由两种或两种以上物质生成一种物质的反应,如2Mg+O₂→2MgO;分解反应是由一种物质生成两种或两种以上物质的反应,如2KClO₃→2KCl+3O₂(加热);置换反应是一种单质与一种化合物反应生成另一种单质和另一种化合物的反应,如Fe+CuSO₄→FeSO₄+Cu;复分解反应是由两种化合物相互交换成分生成另外两种化合物的反应,如NaCl+AgNO₃→NaNO₃+AgCl↓,氧化还原反应是电子转移的反应,表现为化合价的升降,如H₂+CuO→Cu+H₂O,其中H₂被氧化,CuO被还原。
实验操作是化学学习的重要环节,包括基本操作和实验安全,基本操作有药品的取用(固体用药匙或镊子,液体用胶头滴管或量筒)、物质的加热(用酒精灯外焰加热)、过滤(一贴二低三靠)、蒸发(用蒸发皿搅拌防止飞溅)等,实验安全需注意:①不能用手直接接触药品;②闻气体时要用手轻轻扇动,使少量气体飘入鼻孔;③稀释浓硫酸时,一定要将浓硫酸沿器壁慢慢注入水中,并不断搅拌;④点燃可燃性气体前,要检验气体的纯度;⑤实验后的废液要倒入指定容器,不能随意倒入下水道。
化学与生活密切相关,许多现象和问题都可以用化学知识解释,铁制品生锈是铁与氧气、水共同作用的结果(3Fe+2O₂+H₂O→Fe₃O₄·xH₂O),防止生锈的方法有涂油、刷漆、电镀等;食品包装中的干燥剂(如生石灰CaO、硅胶)可吸收水分,防止食品变质;肥皂和洗涤剂的去污原理是乳化作用,将油污分散成细小液滴随水冲走;人体胃液中的盐酸可帮助消化,但过多会导致胃酸过多,需服用含Al(OH)₃或NaHCO₃的药物中和,环境问题如酸雨(主要由SO₂、NO₂等酸性气体引起)、温室效应(主要由CO₂等气体引起)也与化学物质密切相关,减少化石燃料使用、开发新能源是缓解这些问题的重要途径。

以下是常见化学物质的性质及用途总结:
| 物质类别 | 代表物质 | 物理性质 | 化学性质 | 主要用途 |
|---|---|---|---|---|
| 金属单质 | 铁(Fe) | 银白色固体,有磁性 | 与酸、盐溶液反应,易生锈 | 建筑材料、制造合金 |
| 非金属单质 | 氧气(O₂) | 无色无味气体,不易溶于水 | 支持燃烧,氧化性 | 供呼吸、医疗急救 |
| 氧化物 | 二氧化碳(CO₂) | 无色无味气体,可溶于水 | 不可燃,不支持燃烧,与水反应生成碳酸 | 灭火、制冷剂 |
| 酸 | 盐酸(HCl) | 无色液体,有刺激性气味 | 具有酸的通性(使指示剂变色、与活泼金属反应等) | 除锈、制药物 |
| 碱 | 氢氧化钠(NaOH) | 白色固体,易溶于水,放热 | 具有碱的通性(使指示剂变色、与酸反应等) | 肥皂、造纸 |
| 盐 | 氯化钠(NaCl) | 白色晶体,易溶于水 | 中和酸性物质,维持生理平衡 | 调味品、防腐剂 |
相关问答FAQs:
-
问题:如何区分纯净物和混合物?
解答:纯净物是由一种物质组成的,具有固定的组成和性质,如蒸馏水、氧气;混合物是由两种或多种物质混合而成的,各物质保持原有性质,没有固定的组成,如空气、溶液,区分方法:①观察外观,混合物可能呈现多种颜色或状态;②测定熔点、沸点,纯净物有固定的熔沸点,混合物没有;③通过化学方法,如电解水,纯净水生成氢气和氧气的体积比为2:1,而含杂质的水可能比例不同。 -
问题:为什么铁在潮湿环境中更容易生锈?
解答:铁生锈是电化学腐蚀过程,需要同时接触氧气和水,在潮湿环境中,铁表面会形成一层电解质薄膜(溶解有氧气的水),铁作为负极失去电子被氧化(Fe-2e⁻→Fe²⁺),氧气作为正极得到电子被还原(O₂+2H₂O+4e⁻→4OH⁻),生成的Fe²⁺与OH⁻结合形成Fe(OH)₂,进一步被氧化为Fe(OH)₃,最终脱水转化为Fe₂O₃·xH₂O(铁锈),干燥环境中缺少水,无法形成电解质溶液,铁的腐蚀速率显著减慢。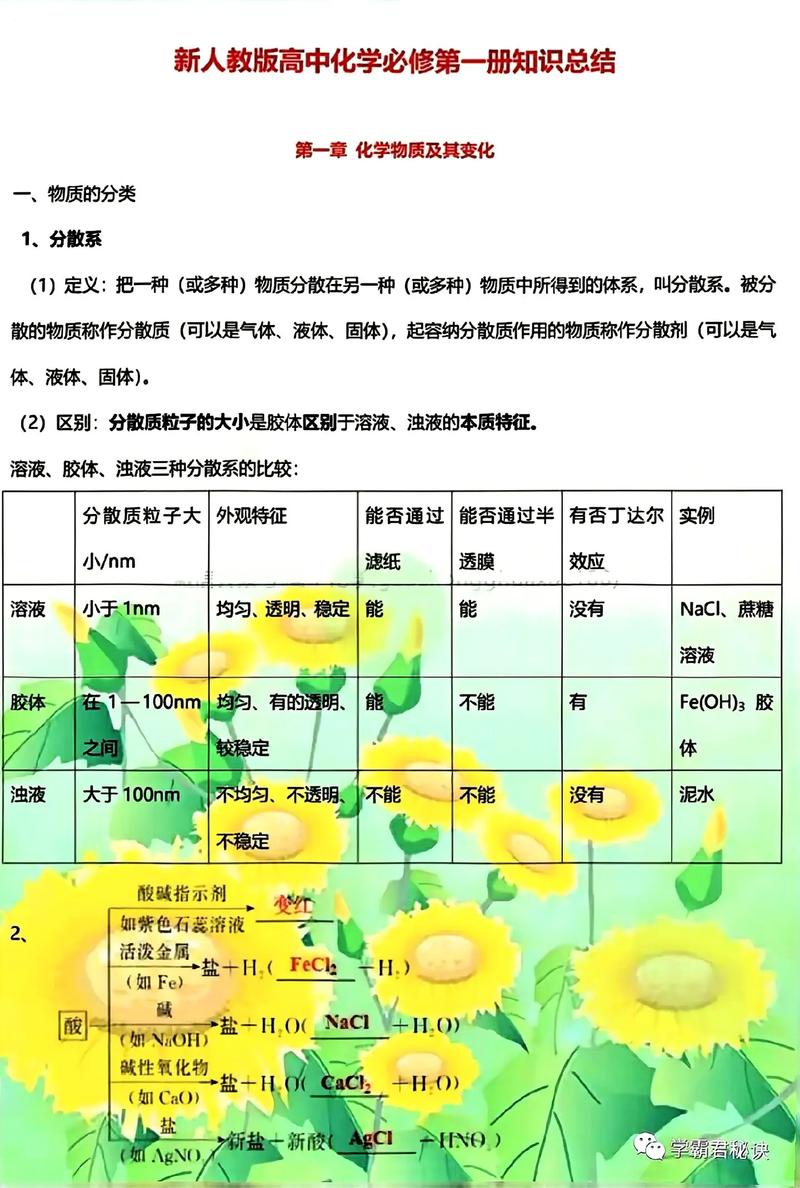 (图片来源网络,侵删)
(图片来源网络,侵删)